UAA 2 – Chimie (SCG)
Clarifications
Cet article à destination des enseignants contient les informations suivantes :
- Phénomène chimique et phénomène physique
- Les fonctions chimiques (acide, hydroxyde, sel, oxyde)
- Construire une formule moléculaire – Notion de valence
- Les réactions chimiques : quelques exemples
Vous avez également accès à un répertoire de fiches d’activité (expériences…) et des ressources.
Ressources
Pictogrammes pour les fiches d’expériences
Les expériences de chimie proposées sur ce site n’exigent pas toutes le même niveau d’expertise, ni les mêmes dispositifs de sécurité.
Voici un classement de chaque activité expérimentale selon les pictogrammes suivants :
| Durée | |||||||
| 1 période | 2 périodes consécutives | 2 périodes espacées | Plus de 2 périodes | ||||
 |
 |
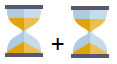 |
 |
||||
| Difficulté | |||||||
| Facile | Moyenne | Plus difficile | Technique (requiert une technique apprise : titrage, solution de concentration précise...) | ||||
 |
 |
 |
 |
||||
| Sécurité | |||||||
| Niveau 1 : Peut être intégrée à un cours. | Niveau 2 : Nécessite le port de tabliers, lunettes… | Niveau 3 : Nécessite le port de tabliers, lunettes, et l'utilisation d'une hotte. | Niveau 4 : Uniquement pour le professeur. | Niveau 5 : Nécessite le port de tabliers, lunettes, et l'utilisation d'une hotte, uniquement pour le professeur. | |||
 |
 |
 |
 |
 |
|||
| Matériel nécessaire | |||||||
| Quotidien (matériel issu de grandes surfaces) | Matériel de laboratoire rudimentaire | Matériel de laboratoire spécifique | |||||
 |
 |
 |
|||||
| Emojis icons created by Darius Dan - Flaticon | |||||||
Répertoire
| DAPV* | Durée | Difficulté | Sécurité | Matériel | |
| Fiches d’activité (FA) | |||||
| FA1 "Les pictogrammes de danger" | A1, T1 | ||||
| FA2 "Produits à usage domestique : attention danger !" | A1, T1 | ||||
| Fiches d’expérience (FE) | |||||
| FE1 "Mélange de limaille de fer et de sable" | C1 |
 |
 |
 |
 |
| FE2 "Réaction entre le fer et le soufre" | C1 |
 |
 |
 |
 |
| FE3 "Phénomènes chimiques" | C2, C5, A4 |
 |
 |
 |
 |
| FE4 "Les fonctions chimiques" | A3, T3 |
 |
 |
 |
 |
| FE5 "Combustion des métaux et des non métaux" | C2, A4 |
 |
 |
 |
 |
| FE6 "Réactions de neutralisation" | C2,C5 |
 |
 |
 |
 |
| FE7 "Réaction entre un acide et un métal" | C2, A4 |
 |
 |
 |
 |
| Fiches techniques (FT) | |||||
| FT1 "Construire une cellule d'électrolyse de l'eau" | |||||
| (*) Développements attendus principalement visés | |||||
Compléments concernant les combustions
La connaissance du triangle du feu et de ses composants est utile pour identifier les moyens de ralentir une vitesse de combustion ou pour l’arrêter complètement. Il « suffit » en effet d’éloigner ou d’ôter complètement un des trois éléments essentiels dans le triangle du feu.
Par exemple, on utilise :
- de l’eau qui va agir du côté de l’énergie d’activation en abaissant la température en dessous du point d’inflammation ;
- de la mousse qui va agir du côté du comburant et du côté du combustible en créant une barrière entre les deux. La mousse opère par étouffement ;
- du dioxyde de carbone qui va agir du côté du comburant, l’oxygène. Il opère aussi par étouffement ;
- de la poudre (de potassium ou de sodium) qui empêche le déroulement de la réaction chimique propre à la combustion. Le potassium ou le sodium s’immisce dans la réaction et inactive les réactifs.
Combustion complète et combustion incomplète
On ne considère, dans ce paragraphe, que les combustibles riches en carbone.
Combustion complète
De façon générale, si la réaction de combustion entre le combustible (par exemple, le gaz d’un briquet) et le dioxygène est conduite en présence de suffisamment de dioxygène, la réaction de combustion est complète car tous les atomes de carbone du combustible forment du dioxyde de carbone CO2.
Combustion incomplète
Les combustions sont très utiles, notamment pour chauffer les maisons, les aliments, … Mais elles peuvent aussi présenter des dangers. L’un de ces dangers est le risque de combustion incomplète.
Lors de l’expérience avec une flamme jaune éclairante, la combustion du gaz de laboratoire produit, outre CO2 et H2O, un dépôt noir sur le creuset : ce dépôt est du carbone C solide (de la suie) contenant souvent des nanoparticules néfastes pour la santé humaine.
Mais outre ce dépôt de carbone solide, il peut aussi se former du monoxyde de carbone CO, un gaz toxique (incolore et inodore). Un défaut de dioxygène est responsable de ces phénomènes et ces réactions de combustion sont appelées incomplètes.
Remarques
- Lorsque les voitures roulent sur autoroute à la vitesse autorisée de 120 km/h, le phénomène de combustion est incomplet : il y a donc production de suie et de nanoparticules. Les autorités décident alors de limiter la vitesse à 90 km/h car à cette vitesse-là, le phénomène de combustion se rapproche beaucoup plus d’une combustion complète.
- Le dioxyde de carbone est un gaz plus dense que l’air ; le monoxyde de carbone, un gaz moins dense que l’air. Dans les salles de bain équipées d’un boiler à gaz, les mesures de sécurité exigent qu’il y ait deux ouvertures vers l’extérieur : une ouverture « basse » permettant au dioxyde de carbone de s’évacuer et une ouverture « haute » pour l’évacuation du monoxyde de carbone.
La respiration
Pour les scientifiques, la respiration est clairement distinguée de la ventilation.
La ventilation (souvent désignée comme étant la respiration dans la vie quotidienne) est le phénomène par lequel l’air contenu dans les poumons se renouvelle par inspiration (entrée de l’air dans les poumons) et par expiration (sortie d’air des poumons vers l’extérieur).
La respiration est un phénomène qui se passe dans la cellule, au niveau des mitochondries (cf. UAA 3). C’est une réaction chimique qui transforme le glucose (nutriment issu de la digestion) en eau et en dioxyde de carbone en présence de dioxygène. C’est également une réaction exothermique (il y a production d’énergie).
Globalement, la respiration est donc une réaction chimique semblable à la combustion d’un combustible riche en carbone.
Sécurité et prévention
Les combustions, nous l’avons vu, comportent certains risques et dangers. Il faut donc adopter un comportement adéquat dans la manipulation, lors du stockage et bien sûr lorsque l’on effectue une combustion.
L’étiquetage est la première information, essentielle et concise, fournie à l’utilisateur sur les dangers des substances et sur les précautions à prendre lors de leur stockage et lors de leur utilisation.
Parmi les informations reprises sur l’étiquette, il y a les pictogrammes de danger.
Les combustibles sont directement concernés par 4 pictogrammes de danger :
| Code | Pictogramme | Mention |
| SGH01 |
 |
|
| SGH02 |
 |
|
| SGH03 |
 |
|
| SGH04 |
 |
|
En outre, les étiquettes comportent également des mentions d’avertissement, des mentions de danger et des conseils de prudence.
Les mentions d’avertissement
Elles indiquent le degré relatif de danger. Il y a deux degrés relatifs de danger :
- DANGER, pour les catégories les plus sévères
- ATTENTION, pour les autres
Les mentions de danger
Elles sont énoncées à l’aide d’une phrase qui décrit la nature du danger que constitue la substance et, lorsqu’il y a lieu, le degré de ce danger. Un code alphanumérique constitué de la lettre « H » et de 3 chiffres est affecté à chaque mention de danger.
Les conseils de prudence
Ils sont énoncés à l’aide d’une phrase qui décrit les mesures de prévention à prendre lors du stockage ou de l’utilisation de la substance. Un code alphanumérique constitué de la lettre « P » et de 3 chiffres est affecté à chaque conseil de prudence.
En conclusion
La lecture attentive d’une étiquette est extrêmement utile pour adopter les mesures adéquates au stockage et à l’utilisation des substances.
Ainsi, dans le cas du butane, l’étiquette comporte les pictogrammes et phrases suivants :
| Mention d’avertissement : | DANGER | |
| Pictogramme : | SGH 02 |
 |
| Phrase H : | H220 | Gaz extrêmement inflammable |
| Phrases P : | P210 | Tenir à l’écart de la chaleur, des étincelles, des flammes nues et des surfaces chaudes. Ne pas fumer. |
| P377 | Fuite de gaz enflammée : ne pas éteindre si la fuite ne peut être arrêtée sans danger | |
| P102 | Tenir hors de portée des enfants | |
| P403 | Stocker dans un endroit bien ventilé |